Как берут кровь на анализ у коровы
 Как и людям, животным тоже необходимо периодически сдавать анализы. Крупный рогатый скот является источником мяса и молока для человека и от того, здорова ли корова, зависят показатели качества этих двух продуктов.
Как и людям, животным тоже необходимо периодически сдавать анализы. Крупный рогатый скот является источником мяса и молока для человека и от того, здорова ли корова, зависят показатели качества этих двух продуктов.
Для того чтобы как можно раньше выявить какие-либо отклонения в работе организма бурёнки, необходимо сдавать биохимический анализ крови.
Анализ проводится для того, чтобы выявить у животного нарушения обмена веществ, недостаток каких-либо полезных веществ в организме. С помощью этой процедуры можно вовремя заметить развитие лейкоза, определить, каким именно инфекционным заболеванием заразилось животное.
Кровь разносит по организму все полезные вещества, витамины и минералы. От того, насколько правильно и быстро осуществляется кровоток, зависит не только общее состояние животного, но и количество получаемого молока. 
Способов взять кровь у скота существует три. Они заключаются в получении образцов из яремной, молочной, хвостовой вены. Их нужно брать исключительно новой и стерильной иглой. Животное обязательно следует фиксировать в неподвижном положении, чтобы оно не травмировало само себя, не перевернуло пробирку. Перед процедурой нужно выстригать шерсть в области, где будет сделан укол, дезинфицировать поверхность раствором фенола, йодом или спиртом. На пробирке с образцом должен присутствовать порядковый номер коровы. Ёмкость ни в коем случае нельзя трясти.
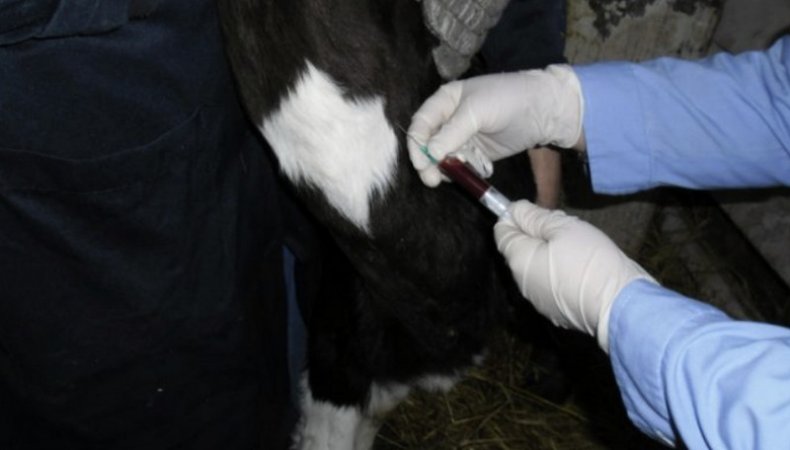
Взятие крови из яремной вены является самым распространённым способом. Рекомендуется проводить процедуру рано утром, перед первой кормлением. Чтобы провести анализ нужно привязать голову бурёнки, зафиксировать её в неподвижном состоянии. Далее следует зажать вену в нижней трети шеи, потом вводить иглу под острым углом. Кончик иглы должен быть направлен к голове животного.
Плюсами такого способа являются:
- животное почти не травмируется;
- лёгкость произведения операции;
- быстрота проведения процедуры.
 Среди недостатков можно выделить:
Среди недостатков можно выделить:
- сильное разбрызгивание крови;
- появление риска распространения инфекций, которые опасны не только для животных, но и для человека;
- сложность фиксации коровы в определённом положении;
- частое возникновение осложнений, которые проявляются в виде абсцессов, гематом;
- стресс у коровы, который может привести к снижению удоя.
Забор образца из молочной вены происходит только у взрослых коров. Упомянутые вены находятся сбоку от вымени, тянутся по брюху снизу. Они снабжают молочную железу кровью и необходимыми питательными веществами. Чем лучше развиты вены, тем больше молока даёт бурёнка. 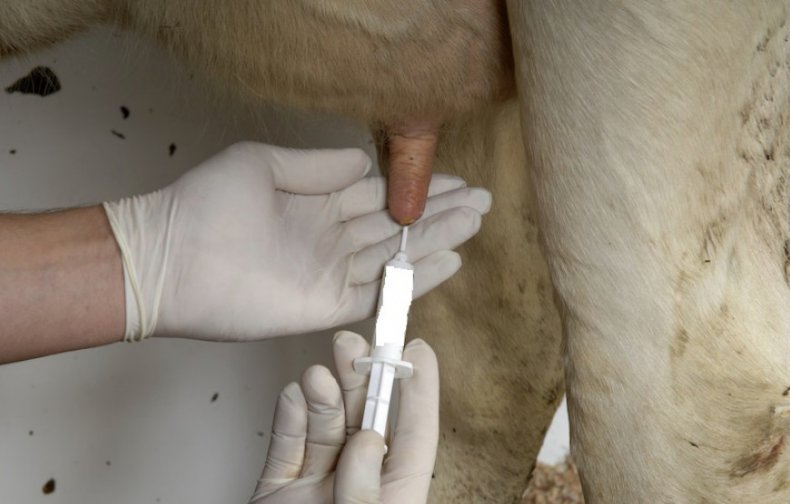 Животное необходимо зафиксировать. Чтобы провести процедуру правильно потребуется несколько человек. Для начала нужно сбрить или максимально состричь волосяной покров в месте укола и обработать участок спиртом или йодом. Перед вами должен быть виден своеобразный небольшой бугорок — это именно то место, куда следует делать укол. Иглу нужно вводить очень осторожно, чтобы не нанести вред животному. Она должна проходить немного под углом, до момента, пока не потечёт тёмная венозная кровь.
Животное необходимо зафиксировать. Чтобы провести процедуру правильно потребуется несколько человек. Для начала нужно сбрить или максимально состричь волосяной покров в месте укола и обработать участок спиртом или йодом. Перед вами должен быть виден своеобразный небольшой бугорок — это именно то место, куда следует делать укол. Иглу нужно вводить очень осторожно, чтобы не нанести вред животному. Она должна проходить немного под углом, до момента, пока не потечёт тёмная венозная кровь.
Положительными сторонами данного метода являются:
- доступная цена материалов, необходимых для проведения процедуры;
- высокая скорость сбора образца;
- меньшее разбрызгивание, чем при взятии образца из яремной вены.
Минусов у такого способа значительно больше, чем плюсов:
- высокий риск травмировать животное;
- контакт с кровью коровы;
- во время процедуры тёлка испытывает огромный стресс, потому что забор образца проводится в очень нежной зоне, которую животное постоянно оберегает;
- сложность проведения процедуры.
Данный способ получения образца крови у крупного рогатого скота устарел. Благодаря новым технологиям, методам и оборудованию такую процедуру проводят гораздо быстрее и легче, минимизируя риски для животного.
Из хвостовой вены брать образец наиболее безопасно. Сейчас всё более популярным становится использование вакуумных систем — это специально сконструированные пробирки, в которых уже присутствует нужный антикоагулянт и снижено давление, чтобы кровь плавно вытекала в ёмкость. 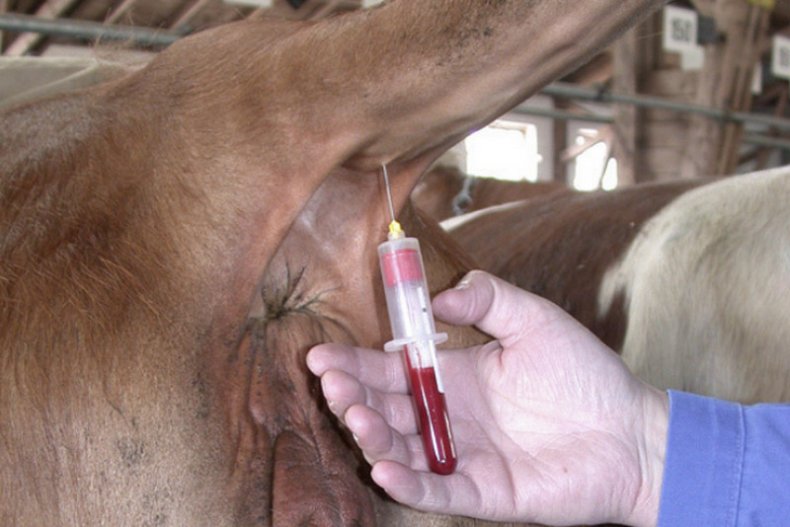 Для осуществления забора образца из хвостовой вены необходимо продезинфицировать место укола. Далее медленно приподнять хвост, удерживая его за среднюю треть. Чтобы процедура прошла наиболее гладко, следует выбрать место на уровне от двух до пяти позвонков, которое делит хвост вдоль на две равные части. Укол должен быть плавным, под углом в 90 градусов. Иглу вводят до упора.
Для осуществления забора образца из хвостовой вены необходимо продезинфицировать место укола. Далее медленно приподнять хвост, удерживая его за среднюю треть. Чтобы процедура прошла наиболее гладко, следует выбрать место на уровне от двух до пяти позвонков, которое делит хвост вдоль на две равные части. Укол должен быть плавным, под углом в 90 градусов. Иглу вводят до упора.
Из явных положительных сторон этого метода можно выделить:
- полученный образец стерилен;
- риск образования сгустков в пробирке значительно снижен;
- не требуется фиксировать животное;
- очень высокая скорость проведения процедуры. Один ветеринар может за час взять до двух сотен образцов;
- крайне малый шанс возникновения побочных эффектов или травм у коровы;
- исключение непосредственного контакта с кровью;
- корова не испытывает стресса и привычный удой сохраняется.
 Минусами упомянутого способа забора крови являются:
Минусами упомянутого способа забора крови являются:
- более высокая стоимость оборудования;
- низкая популярность упомянутого метода.
При проведении биохимического анализа крови выделяют несколько основных показателей, которые являются наиболее важными при ведении молочного и мясного хозяйства. Чтобы лучше понимать, как должны выглядеть идеальные анализы, следует знать таблицу норм:
Приветствую всех посетителей блога. Предлагаю вернуться к основам кормления. Что нужно знать для балансировки рациона коровам? Это не только химический анализ кормов, но биохимические показатели крови крс. В ходе исследований можно увидеть реальную картину обмена веществ у животных.
Если вы не знаете, что такое биохимические исследования проб сыворотки крови, обратитесь к своему ветеринарному врачу. У него наверняка есть похожий документ, который я выложил здесь ниже. Если нет, срочно с ветеринарной службой исследуйте кровь стада. Это даст ответы на многие вопросы.
Биохимический анализ крови – это метод лабораторный диагностики, который позволяет определить работу внутренних органов, получить информацию о метаболизме (обмене веществ) и выяснить потребность в макроэлементах.
Если вам сложно уловить суть, то попробуйте перевести данную проблему на самого себя.
Вы заболели, пошли в поликлинику, записались к врачу на прием. Что первым делом он просит вас сделать? Правильно! Сдать анализы.
Вот и в животноводстве все аналогично. Только необходимо работать на опережение. Увидев картину биохимии, зоотехник может подкорректировать рацион под потребность животного.
А за этим следует улучшение здоровья и, как правило, увеличение продуктивности.
Хочу отметить, что пробы крови, представленные в документе, взяты от проблемных коров. К примеру, у коровы по кличке Аура был кетоз. Данное заболевание подтвердило наличие кетоновых тел в сыворотки крови.
Правильнее будет взять пробы крови у нескольких физиологических групп:
- нетели
- коровы в фазу раздоя
- коровы второй половины лактации
- сухостой первой половины
- сухостой второй половины
Возьмите от каждой группы минимум 10 образцов проб.
В этом месяце я обязательно со своей ветеринарной службой возьму еще раз кровь на биохимию и обязательно поделюсь с вами итогами анализов.
Кальций – является основным элементом в строении костной ткани, крови, нервной и мышечной ткани.
Фосфор, так же как и кальций, основа костной ткани. Участвует в обмене жиров и углеводов. Данный элемент необходим для нормального развития микроорганизмов в рубце коровы.
«Недостаток кальция и фосфора в организме животных может привести к рахиту, остеомаляции, остеопорозу, остеофиброзу».
Белок (он же протеин) – главная составляющая всех живых клеток. Протеин участвует во всех жизненно важных процессах: размножении, росте, развитии, продуктивности, а так же является основным компонентом ферментов, гормонов и иммунных тел.
Как видите, роль белка в организме значима, более подробно о роли протеина и других элементов, мы еще поговорим в отдельных статьях на блоге.
Резервная щелочность – по сути это показатель кислотно-щелочного соотношения в организме.
«Количество двуокиси углерода (мл), которое может связать100 мл плазмы крови»
Снижение данного параметра говорит о сдвиге кислотно-щелочного равновесия в сторону ацидоза, повышение — в сторону алкалоза.
Каротин – является провитамином (биохимическим предшественником витамина А). Витамин А участвует в развитии и росте клеток, обеспечивает нормальное состояние слизистых оболочек, поддерживает зрительные функции.
Кетоновые тела – промежуточные продукты обмена веществ белков, жиров и углеводов, которые образуются в печени. Это бета-оксимасляная кислота, ацетоуксусная кислота, ацетон. Повышенный уровень таких веществ говорит о нарушении обмена веществ.
- кальций 2,5 – 3,13 ммоль/л
- фосфор 1,45 – 1,94 ммоль/л
- белок 72- 86 г/л
- каротин 0,4 – 1,0 мг%
- резервная щелочность 46 -66%
Отлично. У нас есть результаты анализов. Мы знаем, на что влияет каждый показатель. Осталось только решить – что с этим делать?
На мой взгляд, есть три варианта развития событий.
1. Постараться сбалансировать рацион, что на практике, практически нереально. Улучшать кормовую базу при заготовке силоса, сенажа, сена. Обратить внимание видовой состав трав (отдать предпочтение сахару или протеину).
2. Включить в рацион животных кормовые добавки, которыми заполнен наш рынок. Здесь только вопрос цены и качества. К примеру, поставщик примексов в мое хозяйство, разработал минеральную добавку, чтобы восполнить пробелы в рационе.
3. Попробуйте найти медикаментозный выход. К примеру, существует множество препаратов, которые содержат витамин А (карток, карсел, элеовит, карофертин, каролин и др). Почему бы вам таким способом не восполнить дефицит данного витамина?
Рекомендации
по правилам взятия проб крови от крупного рогатого скота
Условия взятия крови и ее сохранность до начала лабораторных исследований имеют важное значение при получении достоверных результатов. Во многом эти результаты зависят от техники взятия крови и используемых при этой инструментов.
При венепункции прокол окружающих вену тканей и стенки вен делают в один прием.
На результаты лабораторных исследований могут влиять факторы, связанные с индивидуальными особенностями и физиологическим состоянием организма животного, такие как: возраст; эмоциональное состояние и психический стресс; климатические и метеорологические условия и др.
Брать кровь надо по возможности утром, до кормления животных.
Рекомендуется произвести дегельминтизацию животных за 2 недели до взятия крови.
В целях отсутствия получения ложно-положительных результатов исследований рекомендуют брать кровь не позднее, чем за три недели до отела и не ранее чем через 3 недели после отела.
На точность и правильность результатов также оказывает влияние техника взятия крови, используемые при этом инструменты (иглы, шприцы и др.), пробирки, в которые берется, а в последующем хранится и транспортируется кровь, а также условия хранения и подготовки пробы к анализу.
Традиционные и широко используемые в настоящее время способы взятия крови с помощью иглы и/или шприца оказываются основными источниками лабораторных ошибок, приводящих к низкому качеству результатов анализов. Кроме того, эти методы не могут быть стандартизованы и не обеспечивают безопасность персонала, берущего кровь.
При взятии проб венозной крови методом самотека с использованием иглы и обычных пробирок высока вероятность попадания крови животного на руки ветеринарного специалиста. В этом случае руки ветеринарного работника могут стать источником передачи и распространения возбудителей гемоконтактных инфекций другому животному путем контаминации кровью инъекционной ранки. Ветеринарный работник сам может заразиться от источника инфекции.
Использование медицинского шприца с иглой для взятия крови следует также избегать из-за его недостаточной безопасности для ветеринарного персонала и невозможности исключения гемолиза крови при переносе пробы под давлением в пробирку.
Взятие крови с использованием вакуум-содержащих систем:
Для взятия проб венозной крови наиболее предпочтительно использовать вакуум-содержащие системы. Этот способ имеет ряд преимуществ, основным из которых является то, что кровь попадает непосредственно в закрытую пробирку, предотвращающую любой контакт ветперсонала с кровью животного.
Речь идёт не только об упрощении процедуры взятия крови, что само по себе немаловажно, но и о значительном снижении процента преаналитических ошибок, увеличении безопасности процедуры, снижении риска заражения скота, сохранения уровня надоев после процедуры и отсутствия осложнений у животных после взятия крови.
Вакуум-содержащая система представляет собой закрытую двухкомпонентную систему — вакуумный шприц-контейнер и специальную иглу. Выделение сыворотки или соединение крови с антикоагулянтом происходит в том же объёме шприца, в который берётся кровь, то есть после взятия крови сам шприц является транспортной пробиркой с антикоагулянтом или сывороткой.
Под действием вакуума кровь втягивается через иглу вакуумной системы напрямую из вены в пробирку и сразу же смешивается с химическим реактивом. Тщательно дозированный объем вакуума обеспечивает точное соотношение кровь/реагент в пробирке.
На основе возможностей вакуум-содержащихх систем был разработан новый метод взятия крови у крупного рогатого скота из хвостовой вены:
1. Кровь берут из v .с occygea (хвостовая вена).
2. Для взятия крови животное не фиксируют.
3. Хвост животного берут рукой в области средней трети и медленно поднимают вверх.
4. Место взятия крови, область 2-5 хвостовых позвонков, дезинфицируют спиртом или 5% раствором йода.
5. Кровь берут в средней трети тела 2-5 хвостовых позвонков, находящейся на линии, идущей вдоль хвоста и делящей его на 2 симметричные части.
6. Иглу вводят под углом 90° до упора на глубину 5-10 мм.
Преимущества взятия крови безопасными системами из хвостовой вены:
1. Сокращение времени взятия крови ветврачом; (до 200 животных за 2 часа)
2. Отсутствие фиксации животного;
3. Исключение контакта ветврача с кровью на всех этапах взятия и транспортировки крови;
4. Предупреждение распространения инфекций через кровь и загрязнения (контаминации) объектов окружающей среды; (особенно актуально при лейкозе КРС)
5. Минимизация осложнений и стресса у животных;
6. Отсутствие сокращения надоев в результате стресса и осложнений
7. Возможность получения стерильной крови.
Взятие крови с использованием кровобрательных игл и пробирок:
Иглы для взятия крови должны быть с коротким срезом и достаточно большим диаметром, чтобы не травмировать противоположную стенку вены и не вызвать повреждения эритроцитов. Иглы перед взятием крови обязательно стерилизуют кипячением. Шерсть на месте взятия крови тщательно выстригают, а кожу дезинфицируют дезинфицирующим раствором.
У крупного рогатого окота кровь берут из яремной вены в верхней трети шеи.
Брать кровь для получения сыворотки надо по возможности утром, до кормления животных. Для серологического исследования берут по 7-10 мл крови от крупного рогатого скота.
При взятии крови из яремной вены иглу вкалывают на границе перехода верхней трети шеи в среднюю. Чтобы вызвать достаточное наполнение вены и уменьшать ее подвижность, вену сдавливает в середине шеи резиновым жгутом или пальцем. При проколе вены необходимо держать иглу в руке так, чтобы направление ее совпало с линией хода вены и чтобы срез иглы был направлен вверх, к голове. Иглу вкалывают под острым углом – в 20–30°. При попадании в вену из иглы вытекает кровь.
Кровь должна стекать по стенке пробирки по избежании разрушения эритроцитов и при необходимости немедленно смешиваться с достаточным количеством антикоагулянта.
Перед извлечением иглы из вены резиновый жгут снимают, пережимают вену пальцем выше места вкола, иглу извлекают, а место вкола некоторое время сдавливают тампоном для предотвращения образования гематомы. В заключении область венепункции дезинфицируют дезинфицирующим раствором.
Недостатки устоявшегося метода взятия крови из яремной вены кровопускательной иглой:
1. Разбрызгивание крови; (попадание крови на руки, кормушки и др. объекты окружающей среды).
2. Высокий риск распространения инфекций, опасных не только для животных, но и для человека; (туберкулез, бруцеллез, лейкоз КРС).
3. Необходимость фиксации животного.
4. Стресс у животного, ведущий к потерям молока (более 5%).
5. Осложнения после взятия крови; (гематомы, абсцессы).
6. Взятая кровь – нестерильна (т.е. контаминирована).
Хранение проб крови и сыворотки крови:
Цельную кровь, плазму и сыворотку для непродолжительного хранения помещают в холодильник (+2…+4°С), длительное хранение сыворотки требует температуры – 20°С.
Сыворотку крови получают методом отстоя. Для свертывания крови и отстаивания сыворотки пробирки с кровью выдерживают 30-60 мин при 20-30°С или 37-38°С, сгусток крови от стенок отделяют стальной спицей, а затем пробирки выдерживают при 4-10°С 20-24 ч.
Отстоявшуюся сыворотку сливают в сухие стерильные пробирки, закрывают пробками и направляют в лабораторию в течение первых суток и в исключительных случаях не позднее третьего дня после взятия крови.
Нарушение условий хранения проб может стать причиной погрешностей анализа. В результате длительного стояния сыворотки, над эритроцитами могут наступить сдвиги в концентрации ряда компонентов: повышается концентрация калия, активности кислой фосфатазы, аминотрансфераз, лактатдегидрогеназы, гидроксибутиратдегидрогеназы, понижается содержание глюкозы вследствие гликолитических процессов.
При температуре около 20°С в цельной крови возрастает содержание аммиака, многие ферменты даже при температуре холодильника быстро теряют свою активность (креатинкиназа, кислая фосфатаза), в лактатдегидрогеназа, напротив, быстрее теряет активность при низких температурах.
Возникший при взятии или хранении гемолиз эритроцитов приводит к повышению концентрации калия, активности кислой фосфатазы, аминотрансфераз, лактатдегидрогеназы, гидроксибутиратдегидрогеназы.
Неумелое встряхивание проб при перемешивании их содержимого или при транспортировке также может вызвать гемолиз эритроцитов.
Мутные, проросшие, гемолизированные сыворотки исследованию не подлежат.
Сыворотку или кровь можно консервировать также борной кислотой (в порошке) из расчета 0,05-0,07 г (на кончике скальпеля) на одну пробирку с кровью (сывороткой).
Пробирки с кровью и сыворотками плотно закрывают стерильными пробками и устанавливают для пересылки в строго вертикальном положении.
Зимой сыворотки упаковывают и пересылают так, чтобы они не замерзли.
Пробы направляют с сопроводительной в двух экземплярах (см. приложение 1).
Взятие крови для гематологических исследований
Кровь для гематологических исследований берут из ярёмной или каудальной (хвостовой) вены в специальные системы забора крови с антикоагулянтом или в пробирки с антикоагулянтами. В качестве антикоагулянтов используют трилон Б (ЭДТА-динатриевая соль этилендиаминтетрауксусной кислоты) из расчета 0,1 мл 10 %-ного раствора на 1 мл крови, гепарин (5ед. на 1 мл крови) или 6%-ный раствор лимоннокислого натрия (0,1 мл на 1 мл).
Для предотвращения свертывания крови содержимое пробирки сразу же тщательно перемешивают. Стабилизированную кровь до исследования хранят в холодильнике при температуре 2-4 0 С и исследуют не позднее, чем через 36 часов с момента взятия.
СЛУЖБА ВЕТЕРИНАРИИ ИРКУТСКОЙ ОБЛАСТИ
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ
_____________ СТАНЦИЯ ПО БОРЬБЕ С БОЛЕЗНЯМИ ЖИВОТНЫХ
Индекс, Иркутская область, _______ район Телефон: (8-395- ) _______
Город (поселок, село) _____, улица _____, дом ___ Е- mail —-. vet @ govirk . ru
должность, Ф.И.О. наименование подразделения
В ___________________________________ ветеринарную диагностическую лабораторию
Направляется____________ проб крови (сыворотки крови) от ________________________
(наименование хозяйства, населенного пункта, района)
Для ___________________ исследования на _______________________________________
(вид исследования) (наименование заболевания) _____________________________________________________________________________Благополучное по _____________________________________________________________
(благополучное, неблагополучное, наименование заболевания)
Исследование проводится первично, повторно (подчеркнуть)
Дата и результат предыдущего исследования __________.___________________ 20 ____г.
Дата взятия крови _____________________________________________________________
Опись прилагается в двух экземплярах.
Ведомость (опись) животных, от которых взята кровь для исследования
Наименование предприятия, хозяйства, , Ф.И.О. владельца животного
Как и людям, животным тоже нужно иногда сдавать анализы. Крупный скот считается источником мяса и молока для человека и от того, здорова ли корова, зависят критерии качества таких 2-ух продуктов.
Для того чтобы как можно до недавнего времени обнаружить какие-нибудь отклонения в работе организма бурёнки, нужно сдавать химический анализ крови.
Анализ проходит для того, чтобы обнаружить у животного нарушение вещественного обмена, минус каких-нибудь полезных веществ в организме. При помощи такой процедуры можно своевременно заметить развитие лейкоза, определить, каким собственно инфекционным заболеванием заразилось животное.
Кровь разносит по организму все полезные вещества, витамины и минералы. От того, как правильно и быстро выполняется кровоток, будет зависеть не только общее состояние животного, но и кол-во получаемого молока.
Возможностей взять кровь у скота есть три. Они заключаются в получении образцов из яремной, молочной, хвостовой вены. Их необходимо брать только новой и стерильной иглой. Животное обязательно необходимо фиксировать в неподвижном положении, чтобы оно не травмировало само себя, не перевернуло пробирку. Перед самой процедурой необходимо выстригать шерсть в области, где будет выполнен укол, обеззараживать поверхность раствором фенола, йодом или спиртом. На пробирке с образцом должен находиться порядковый номер коровы. Ёмкость не нужно трясти.
Взятие крови из яремной вены является самым популярным способом. Лучше всего проводить процедуру с самого утра, перед первой кормлением. Чтобы провести анализ необходимо привязать голову бурёнки, закрепить её в неподвижном состоянии. Дальше следует зажать вену в нижней трети шеи, потом вводить иглу под острым углом. Кончик иглы должен быть направлен к голове животного.
Плюсами этого метода считаются:
- животное практически не травмируется;
- лёгкость произведения операции;
- быстрота проведения процедуры.
Из минусов можно выделить:
- сильное распыление крови;
- возникновение риска распространения инфекций, которые опасны не только для зверей, но и для человека;
- сложность фиксации коровы в определённом положении;
- регулярное появление сложностей, которые появляются в виде абсцессов, гематом;
- стресс у коровы, способного привести к уменьшению удоя.
Забор образца из молочной вены происходит только у взрослых коров. Упомянутые вены находятся с боковой стороны от вымени, тянутся по брюху снизу. Они снабжают молочную железу кровью и нужными питательными веществами. Чем лучше развиты вены, тем больше молока даёт бурёнка.
Животное нужно закрепить. Чтобы провести процедуру правильно потребуется пару человек. Для начала необходимо побрить или максимально состричь волосяной покров в месте укола и обработать участок спиртом или йодом. Перед вами должен быть виден необычный маленькой бугорок — это собственно то место, куда необходимо делать укол. Иглу необходимо вводить крайне осторожно, чтобы не навредить животному. Она должна проходить чуть-чуть под угол, до момента, пока не потечёт тёмная венозная кровь.
Хорошими сторонами этого способа считаются:
- доступная стоимость материалов, нужных для проведения процедуры;
- большая скорость сбора образца;
- меньшее распыление, чем при взятии образца из яремной вены.
Минусов у этого метода намного выше, чем достоинств:
- большой риск травмировать животное;
- контакт с кровью коровы;
- во время процедуры тёлка чувствует очень большой стресс, из-за того что забор образца проходит в очень нежной зоне, которую животное регулярно оберегает;
- сложность проведения процедуры.
Этот способ получения образца крови у крупного скота устарел. Благодаря передовым технологиям, методам и оборудованию эту процедуру проводят намного быстрее и легче, минимизируя опасности для животного.
Из хвостовой вены брать образец наиболее безопасно. В настоящий момент все достаточно популярным становится применение вакуумных систем — это специально сконструированные пробирки, в которых уже находится необходимый антикоагулянт и снижено давление, чтобы кровь медленно текла в ёмкость.
Для выполнения забора образца из хвостовой вены нужно продезинфицировать место укола. Дальше не быстро поднять хвост, удерживая его за среднюю треть. Чтобы процедура прошла наиболее гладко, необходимо подобрать место на уровне от 2-ух до пяти позвонков, которое делит хвост вдоль на две одинаковые части. Укол должен быть плавным, под угол в 90 градусов. Иглу вводят до конца.
Из явных хороших сторон такого способа можно выделить:
- получившийся образец стерилен;
- риск образования сгустков в пробирке существенно снижен;
- не потребуется фиксировать животное;
- очень большая скорость проведения процедуры. Один ветеринар может за час взять до 2-ух сотен образцов;
- очень небольшой шанс проявления нежелательных эффектов или травм у коровы;
- исключение непосредственного контакта с кровью;
- корова не чувствует стресса и обычный удой сберегается.
Минусами упомянутого способа забора крови считаются:
- очень большая цена оборудования;
- невысокая востребовательность упомянутого метода.
При проведении химического анализа крови выделяют несколько главных показателей, которые являются самыми основными при ведении молочного и мясного хозяйства. Чтобы лучше понимать, как должны смотреться безупречные анализы, необходимо знать таблицу норм:
Чтобы оценить состояние здоровья коров, у них берут анализы: мочу и кровь. У ветеринара есть предписание, делать это регулярно, чтобы предупредить или выявить заболевания КРС. Исследованию подвергаются все животные в стаде.
Биохимический анализ крови выявляет нарушение обмена веществ у коров, развитие лейкоза, инфекционные заболевания. Анализируя результаты, назначается определённое лечение или даются рекомендации по изменению рациона питания.
Кровь у коровы берут из ярёмной вены. Она проходит в области шеи. Перед забором крови животное не кормят, не дают воды. Корову фиксируют, чтобы она не сломала иглу шприца. В лаборатории проводят биохимический анализ:
- определяют уровень рН в крови. Он показывает количество кислоты и щёлочи в организме. У здоровой коровы он составляет 7,44 единицы. Норма говорит о том, что все внутренние органы работают нормально, никакой инфекции у животного нет, рацион питания сбалансирован. Норма резервной щёлочи – 66%;
- определяют гематокрит, количество эритроцитов в крови. Показатель в норме у КРС – 45%, 7,0 млн/мкл. Он означает, что в организме для доставки кислорода к органам достаточно красных кровяных телец;
- как работают лёгкие, хватает ли кислорода в крови для организма, показывает другой анализ, на гемоглобин. В норме он у КРС – 14%. Белок в крови соединяется с железом, которое удерживает кислород;
- аномальная форма гемоглобина – метгемоглобин. Он не способен доставлять кислород в клетки тканей. Завышенный показатель укажет на кислородное голодание организма. Его количество в норме – до 350 мкмоль/л;
- анализ крови коровы на лейкоциты указывает на развитие воспалительного процесса в организме. В норме уровень составляет – 9,1 тыс/мкл. Повышенный показатель говорит о том, что у коровы начинает прогрессировать опухоль;
- кетоновые тела необходимы для нормальной работы сердца, почек, головного мозга, мышц. Он синтезируется в печени. Нормальное количество – 6 мг. В процессе обмена веществ кетоновые тела способствуют выделению уксусной кислоты и ацетона. Их количество необходимо анализировать. Повышенный уровень указывает на диабет, большое количество сахара. Норма составляет – до 1,4 мг. Ещё одним соединением является бета-оксимасляная кислота. Её норма 4,6 мг.
С помощью биохимического анализа крови коровы определяют уровень свободных жиров и микроэлементов.
Если показатели не соответствуют норме, то у КРС диагностируют нарушение метаболического процесса.
Это явление приводит к костным заболеваниям, сердечно-сосудистым нарушениям, аномальным проявлениям в мягких тканях.
Уровень свободных жиров в норме – до 15,0 %. Если жиров выявлено больше, то это указывает на ожирение общего организма или отдельных внутренних органов. Корова может оставаться с нормальным весом, но сердце, печень или почки покрываются жировым слоем. Это проводит к дисфункции органов.
При нормальном уровне минеральных веществ у коровы в крови устанавливаются следующие показатели (мг):
- кальций – 9-13;
- фосфор – 4,5-7,5;
- каротин при стойловом содержании – 0,4-1,0
- каротин при пастбищном содержании – 0,9-2,8
Количество электролитов измеряется в ммоль/л:
- магний – 0,8-1,23;
- натрий – 130-145;
- калий – 5,1-6,4;
- железо – 20-36;
- марганец – 1,8-3,6.
Чтобы подтвердить анализ крови, берут на исследование мочу и молоко у коровы. Недостаток каротина чаще всего бывает у молодняка. Нехватка витамина влияет на развитие костей, органов зрения, функции слизистых. Показатель не одинаков при различных условиях содержания животных.
Установлено, что лейкоз или лейкемия, относится к вирусным заболеваниям. Чаще всего вирус охватывает особей 4-7 лет. При развитии заболевания происходит изменение структуры крови.
Это приводит к образованию злокачественных опухолей внутренних органов организма. При анализе крови на лейкоз обнаруживается повышенный уровень лейкоцитов, поэтому ещё одно название заболевания – белокровие.
Показатель достигает 9 тыс. клеток на 1 мкл крови.
Вирус в организм животного попадает через ЖКТ, слизистые, через сперму при оплодотворении, через молозиво.
Если поражённое животное не было выявлено и находилось вместе со стадом, то риск заражения других особей максимален.
В организм телёнка вирус попадает с молозивом. На ферме объявляется карантин.
Начало развития заболевания распознать трудно. Уровень лейкоцитов в крови может соответствовать норме.
Заболевание переходит в хроническую стадию. Инкубационный период затяжной, до 2 лет.
Ветеринары по установленному графику обязательно проводят анализ на реакцию иммунодиффузии (РИД). Он призван установить наличие вируса в крови.
Анализ показывает резкое повышение уровня лейкоцитов, изменение в клетках: их недоразвитость. Обязательно берут на исследование сперму и молоко.
К внешним признакам лейкоза относится нехарактерное поведения животного и ухудшение качества молока.
Одни специалисты утверждают, что молоко и мясо коровы с лейкемией на ранней стадии, можно употреблять в пищу. Необходима лишь термическая обработка продуктов. Другие говорят, что для человека опасно даже кипячёное молоко и варёное мясо, если они были произведены больной коровой.
При дальнейшем развитии белокровия у животного отмечаются изменения в ЖКТ. Корова становится малоактивной, страдает несварением кишечника, повышенным газообразованием, запором или диареей. В каловых массах появляются кровяные сгустки.
При терминальной стадии лейкемии кровь перестаёт выполнять свою функцию. Иммунная система не работает. Животное не может противостоять вирусу. Оно погибает. Если телёнок заразился лейкозом от кормилицы, то он умирает через 2 недели.
Против лейкемии КРС рекомендуют прививать вакцину. Она проводится в 2 этапа. На первом этапе вводятся препараты 6-меркаптурин, циклофосфамид. Для второго этапа применяют метотраксат. Вакцины вводят с промежутком в 3 дня.
Способ введения сложный эндолюмбальный. Иглу вводят в спинной мозг. Процедуру рекомендуют проводить в специальном помещении. Недопустимо вакцинировать КРС от лейкоза в условиях коровника или в открытых загонах.
Ветобслуживание КРС 2 раза в год анализ крови и прививки
| № | Полезная информация |
|---|---|
| 1 | перед стойловым периодом в середине или поздней осенью коров обрабатывают от паразитов, через пятьдесят дней можно организовать серологические и гематологические процедуры |
| 2 | перед выгоном стада после завершения зимнего сезона повторяют осенние манипуляции |
Онкогенный лейкозный вирус РНК вызывает хроническое инфекционное заболевание у КРС под названием лейкоз. Он поражает кроветворные органы и возбуждает начало опухолевого процесса. Если разрезать тушу убитой коровы, можно заметить, что все органы внутри покрыты опухолями.
Течение заболевания проходит три этапа, каждый из которых имеет определённые временные промежутки:
- инфекционная стадия является начальной, без проявления внешних симптомов, продуктивность и здоровье животного кажутся в норме, но в это время зараженные головы уже вирусоносители и передают белокровие сородичам. До первых признаков может пройти несколько лет;
- патологическая стадия начинается с проявления внешних признаков: угнетенного состояния, выпучивания глаз, увеличения лимфатических узлов и ряда других. В данный период болезнь можно спутать с другими (туберкулез, мастит и прочие);
- опухолевая стадия отмечается абортами стельных животных, невозможностью забеременеть, проблемами с пищеварением (понос, запор), потерей веса и снижением продуктивности. После обнаружения явных симптомов и до момента гибели взрослой особи КРС может пройти всего несколько часов, максимум дней. Телятам часто удается растянуть этот интервал до двух месяцев.

Изучены особенности адаптации коров красно-пестрой голштино-фризской породы к воздействию низких температур разного диапазона при холодном беспривязно-боксовом способе содержания в климатических условиях Центрально-Черноземного района России.
Установлено, что температурные воздействия -5 0С и -20 0С вызывают в организме коров изменения углеводного, белкового и липидного обменов, мобилизацию энергетических резервов организма, нарушение функции печени и желудочно-кишечного тракта, что подтверждается достоверными изменениями в содержании глюкозы, общего белка, креатинина, мочевины, билирубина, холестерина, ферментов АлАТ, АсАТ в сыворотке крови.
При этом выраженность изменений биохимических параметров достоверно выше при воздействии более низкой температуры, а их характер может указывать на развитие стресс-реакции и срочную мобилизацию энергетических резервов организма для преодоления стрессорного воздействия.
2. Авылов Ч. Стресс-факторы и резистентность животных // Животноводство России. – 2000. – № 11. – С. 20-21.
3. Бусловская Л. К. Энергетический обмен и кислотно-щелочной баланс у сельскохозяйственных животных при адаптации к стрессорам / Л. К. Бусловская. – Белгород: Изд-во БелГУ, 2003. – 188 с.
4. Василисин В. В., Соколов В. В., Голубцов А. В. Физиолого-биохимические показатели крови коров красно-пестрой породы и коров симментальской породы австрийской селекции // Вестник Воронеж. гос. аграр. ун-та. – 2009. – №1 (20). – С.58-63.
5. Горизонтов П. Д. Стресс и система крови. – М.: Медицина, 1983. – 240 с.

6. Громыко Е. В. Оценка состояния коров методами биохимии // Экологический вестник Северного Кавказа. – 2005. – № 2. – С. 80-94. 7. Донник И. М., Шкуратова И. А. Особенности адаптации крупного рогатого скота к неблагоприятным экологическим факторам окружающей среды // Ветеринария Кубани. – 2009. – № 5. – С. 16-17.
8. Кудрин М., Ижболдина С. Роль микроклимата в продуктивности коров // Молочное скотоводство. – 2011 (август). – С. 33-34.
9. Кушнерова Н. Ф., Спрыгин В. Г., Фоменко С. Е. Влияние стресса на состояние липидного и углеводного обмена печени, профилактика // Гигиена и санитария. – 2005. – № 5. – С. 17 – 21.10. Ходанович Б. Холодное содержание молочных коров: за и против // Животноводство России. – 2008. – № 11. – С. 39-42. Введение
Интенсификация молочного животноводства и перевод его на промышленную основу предъявляют повышенные требования к состоянию крупного рогатого скота. В настоящее время в условиях средней полосы России широко применяется холодный метод содержания молочного поголовья, при котором практикуется содержание скота с первых дней жизни без регуляции параметров микроклимата, что идет вразрез с климатическими особенностями наших регионов.
По действующим требованиям к микроклимату коровников они должны быть оборудованы системами вентиляции и отопления, чтобы обеспечить в помещениях температуру 10 0С и относительную влажность не выше 75 %.
Эти нормативные параметры необходимо поддерживать в течение всего периода эксплуатации животных. Т.е. «холодное содержание» действует в нарушение этих норм. Несоответствие факторов микроклимата физиологическим потребностям организма вызывает систематические функциональные нарушения, предрасполагающие к развитию таких заболеваний как маститы, копытная гниль и т. д.
В связи с этим важным является изучение беспривязно-боксового холодного способа содержания коров, характеризующегося наиболее широким спектром стрессирующих факторов [9; 10].
Высокопродуктивные животные, обладая интенсивным обменом веществ и энергии, склонны к нарушениям гомеостаза, сохранение которого сопровождается напряжением компенсаторных механизмов.
Величина энергозатрат на приспособление к неблагоприятным условиям, так называемая «цена адаптации», при этом возрастает. Для сельскохозяйственных животных это выражается в непроизводительном расходовании кормов и снижении продуктивности.
Анализ биохимических параметров крови позволяет судить о состоянии углеводного, белкового, липидного обменов, выявить непродуктивные энергозатраты организма [1; 3; 5; 6].

Цель работы – изучить биохимические параметры крови коров при воздействии отрицательных температур разного диапазона, в условиях беспривязно-боксового холодного способа содержания.
Материал и методы исследования
Экспериментальная часть работы была выполнена в условиях молочно-товарной фермы «Петровка – 1» Белгородского района, где содержится 150 голов коров красно-пестрой голштино-фризской породы. В хозяйстве применяется холодный беспривязно-боксовый способ содержания.
Исследование особенностей адаптации коров к воздействию низких температур осуществлялось в двух сериях эксперимента: в первой – изучали адаптацию коров к воздействию температуры -5 0С, во второй: -20 0С, поголовье контрольной группы содержалось при температурных условиях 15 0С.
Забор крови производился из яремной вены в одно время при одинаковых внешних условиях до утреннего кормления.
Результаты собственных исследований и их обсуждение
Показатели крови являются индикатором работы всего организма, они могут характеризовать уровень адаптации животных к различным стрессирующим факторам, в том числе и к конкретным условиям содержания [6]. В табл. 1 представлены биохимические показатели крови коров при воздействии температуры -5 0С.
Таблица 1. Биохимические показатели крови коров при воздействии температуры -5 0С
| Показатель | Группы | |
| Контроль | Опыт | |
| Глюкоза, ммоль/л | 3,04±0,08 | 2,77±0,07* |
| Общий белок, г/л | 80,1±1,4 | 80,7±1,02 |
| Мочевина, ммоль/г | 4,88±0,09 | 4,05±0,34 |
| Креатинин, ммоль/л | 71,4±1,0 | 62,7±2,3* |
| Билирубин, ммоль/л | 8,6±0,1 | 18,2±0,4** |
| АлАТ, ммоль*ч | 0,29±0,01 | 0,62±0,01** |
| АсАТ, ммоль*ч | 0,33±0,01 | 0,92±0,15* |
| Холестерин, ммоль/л | 5,01±0,06 | 3,41±0,05* |
| Тимоловая проба, ед. | 1,59±0,07 | 1,97±0,13 |
Примечание: достоверные изменения по сравнению с контрольной группой (гр. №1)* – при Р
Поскольку лейкемия протекает незаметно, очень важно своевременно диагностировать ее для недопущения распространения. Для этого необходимо использовать достоверные способы обследования на вирусоносительство лейкоза у коров. На сегодняшний день выбор специалистов ложится на серологический метод:
- реакция иммунодиффузии в геле агара (РИД);
- иммуноферментный анализ (ИФА).
Антитела с реакцией осаждения взаимодействуют с растворимыми антигенами вируса лейкоза крупного рогатого скота (ВЛКРС). Их находят в срок от четырнадцати до шестидесяти дней после момента инфицирования. Также после этого они могут обнаруживаться на протяжении всего существования коровы.
Исследование крови на лейкоз у коров по методу РИД начинается с взятия сыворотки крови больного животного:
- на пластинку наносят капельку сыворотки и каплю реактива. Помутнение жидкости укажет на вирусоносительство лейкоза у коров до выявления клинических показателей;
- проба покажет, был ли у организма указанной особи контакт с вирусом лейкоза;
- в таком состоянии животное может оставаться до конца жизни, но не болеть и не давать клиники белокровия;
- при положительных результатах РИД убирают сомнительных коров в стадах, где их процент не превышает десять процентов. Когда «инфицированных» свыше половины, ликвидируются только клинические зараженные головы.
Иммуноферментный анализ допускает исследование не только крови, но и молока. Большая чувствительность ИФА дает шанс более оперативно и широко изучать сыворотки крови. Метод показывает поголовье, в которых степень заразности не больше процента.
Чтобы не допустить неправильный результат, нужно соблюдать условия проведения исследования крови на лейкоз у коров:
- у беременных буренок кровь берется за месяц до родов или после;
- выявление других возможных инфекционных заболеваний;
- обнаружение паразитов, избавление от них. После этого ИФА разрешается через месяц, а РИД через два месяца по завершению обработки;
- любые вакцины применяют после взятия анализов на пробы. Либо по прошествии двух месяцев;
- гематологическое обследование учитывает подсчет лимфоцитов в крови. Его можно инициировать телятам с полутора лет, если до этого методом РИД и ИФА были найдены антитела ВЛКСР.
Последний гематологический способ также позволяет развеять сомнения при тесте РИД.
При равно положительном выводе корову отправляют на убой. А если и после повторного обследования РИД остается отрицательным в отличие от гематологического метода, животное признается здоровым.
Ю.А. Корчагина – лаборант отдела лабораторных исследований службы технологического консультирования ГОАУ ЯО «Информационно-консультационная служба»
Исследованиями установлена положительная корреляция удоя и содержания белка в молоке с активностью ферментов крови АЛТ и АСТ. Наибольшее содержание жира и белка – в молоке коров ярославской породы.
Молочная продуктивность обуславливается согласованной напряженной работой всего организма коровы. Исследования ряда авторов показывают, что для образования 1 л молока необходимо, чтобы через молочную железу коровы проходило 400-500 л крови.
Все компоненты молока образуются из крови, которая поступает в молочную железу. Однако состав крови и молока существенно различаются.
Так, сахара в молоке в 90 раз больше, чем в крови, жира – в 9 раз, кальция в 13, фосфора – в 10 раз.
В то же время белка в нем вдвое, а натрия в 7 раз меньше, чем в крови.
Белки молока образуются в вымени, как в результате фильтрации определенных составных частей молока из кровеносного русла, так и синтеза компонентов молока в процессе клеточного обмена в альвеолах.
Казеин, лактоальбумин, лактоглобулин молока синтезируются из аминокислот, доставляемых с кровью, в молочной железе. Таким образом, для 80-90% белков молока, предшественниками являются свободные аминокислоты крови.
Остальные 10-20% белков молока, то есть иммунные глобулины и сывороточные альбумины, являются идентичными этим белкам в крови, так как проникают в молоко из крови в неизменном виде путем диффузии (Богатова О.В., Догарева Н.Г., 2004).
Кровь в организме играет исключительно важную роль, поскольку через нее осуществляется обмен веществ. Она доставляет к клеткам органов тела питательные вещества и кислород, удаляя продукты обмена и углекислоту.
По данным биохимических показателей крови можно судить об интенсивности обменных процессов, следовательно, об уровне молочной продуктивности животных.
Г.А. Бондаренко (1983) предлагает использовать метаболиты крови в качестве дополнительных тестов в селекции, направленной на повышение молочной продуктивности крупного рогатого скота, путем выявления и последующего разведения животных, метаболический уровень которых свойственен коровам с высокими показателями молочной продуктивности.
Исследования связи между показателями молочной продуктивности и биохимическими показателями крови имеют научную новизну, в доступной литературе данных не имеется.
Использование их в селекционной работе позволит повысить молочную продуктивность коров.
Поскольку ферменты крови, их активность, уровень обмена веществ, а также биохимическая адаптация закодированы в наследственности животных, в их генах, то можно полагать, что биохимический состав крови у животных в определенной мере связан с их племенными и продуктивными качествами.
Среди различных ферментов, связанных с обменом аминокислот и белков, особый интерес представляют аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ).
В ЗАО СП «Меленковский» нами было отобрано 30 полновозрастных коров с учетом возраста, продуктивности и живой массы. Из них сформировано 3 группы по принципу пар-аналогов по 10 голов соответственно ярославской, голштинской пород и улучшенного ярославского скота с кровностью по голштину от 3,1 до 87,5%.
Исследование биохимических показателей крови проводили в весенне-летний период общепринятыми методамис использованием современного полуавтоматического биохимического анализатора «Vitalon-400», рассчитанного на минимальное использование сыворотки крови (до 1 мл).
Кровь для исследования отбирали до утреннего кормления из яремной вены у коров, не имеющих признаков травматического ретикулита, мастита, эндометрита и других заболеваний, которые могут оказать влияние на биохимические показатели.
Определение общего белка в сыворотке крови проводилось биуретовым методом, разработанного в 1949 году Горналлом, Бардавиллом и Дэвидом, а ферментов аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) – оптимизированным энзиматическим кинетическим методом.
Методы исследования: общезоотехнические с биометрической обработкой материалов по Е.К. Меркурьевой (1977); определены средняя биометрическая М, ее ошибка m, коэффициент корреляции r. В таблице 1 приведены основные показатели биохимического анализа крови.

УЛУЧШЕННЫЙ ТИП ЯРОСЛАВСКОГО СКОТА
У лактирующих полновозрастных коров ярославской породы в изученный период отмечено повышенное, в сравнении с голштинскими и улучшенными сверстницами, содержание общего белка крови в среднем на 4,3 г/л и 4,9 %.
Но при этом у них же была выявлена пониженная, в сравнении с коровами голштинской породы, активность ферментов переаминирования – АСТ, АЛТ на 32,3 ед/л и 24,6 %; на 4,9 ед/л и 15 % и повышенная, по сравнению с помесями, активность ферментов аминотрансфераз на 12,4 ед/л и 12,5 %; на 2,6 ед/л и 9,2 % соответственно.
Это, в определенной степени, указывает на более напряженный обмен белков и усиленное их использование животными ярославской породы.
По-видимому, генетически обусловленные особенности белкового обмена обеспечивают лучший качественный состав молока у этих животных – большее содержание белка (3,63 %) при достаточно высокой жирности (4,07 %).
У коров голштинской породы при высоких удоях (7114,5 кг) резко возрастают обменные процессы всех систем. У них выявлена повышенная по сравнению с указанными породами активность ферментов АЛТ и АСТ в среднем на 6,23 ед/л и 18,8 %; на 38,43 ед/л и 29,3 % соответственно.
Таким образом, ферменты сыворотки крови (АЛТ и АСТ) связаны с уровнем молочной продуктивности и породной принадлежностью животных и, следовательно, могут служить интерьерным ориентиром при углубленной селекции высокопродуктивного молочного скота.
Прогнозирование молочной продуктивности с использованием показателей крови, как указывают Е.В. Эйдригевич, В.В.

Раевская (1978), требует особенно четких представлений о биосинтезе компонентов молока, их предшественниках и факторах, контролирующих молокообразование.
Лактация – очень сложный процесс, и секреция молока в молочной железе всего лишь заключительный его этап. Вначале в ряде внутренних органов –желудке, кишечнике, печени и других – происходит образование предшественников молока.
Учитывая важность сопряженности селекционных признаков в теоретическом и практическом плане, рассчитаны коэффициенты корреляции между отдельными продуктивными признаками у лактирующих полновозрастных коров ярославской, голштинской пород скота и улучшенных генотипов.
Установлена ярко выраженная отрицательная корреляционная связь между удоем за 305 дней лактации и содержанием белка во всех изученных породах (r от -0,23 до -0,81).
Положительная связь между удоем и содержанием жира отмечена у голштинской породы (r=0,25) и улучшенного типа ярославского скота (r=0,14).
Полученные материалы показывают, что с увеличением удоев коров голштинской породы и голштинизированных ярославок имеется слабая тенденция к увеличению процента жира и к снижению белка в молоке.
При этом получена высокая положительная связь междукачественными показателями молока у голштинской (r=0,71) и ярославской (r=0,69) породами, что позволяет эффективно проводить отбор животных по одному из признаков, не снижая уровень второго. Таким образом, увеличивая содержание белка в молоке, можно получать больше продуктов (сыра, творога) за счет увеличения казеина в молоке и при этом не снижая в них массовое содержание жира.
Принимая во внимание перспективы использования биохимических показателей крови в селекционно-племенной работе, следует отметить, что природа корреляций между компонентами крови и признаками продуктивности животных основана на твердо установленных фактах, определяющих роль генов в синтезе белков (Патрушев Л.И., 2002).
Другим подходом для успешного ведения племенной работы и совершенствования существующих пород и раннего прогнозирования будущей продуктивности молочного скота необходимо изучение взаимосвязи между величиной молочной продуктивности и биохимическими показателями крови, так как они имеют непосредственное отношение к процессам молокообразования.
Установлено, что между общим белком сыворотки крови и показателем массовой доли жира в молоке у коров разных пород проявлялась отрицательная связь. Наиболее высокая обратная связь оказалась у коров голштинской породы (r=-0,32), самая низкая наблюдалась у коров ярославской породы (r=-0,06).
Средняя положительная коррелятивная связь найдена между белком крови и белком молока уголштинизированного скота (г=0,47).
Выявлена положительная связь между активностью ферментов переаминирования (АЛТ и АСТ) и удоем у улучшенного типа ярославского скота.
Наиболее значимая высокая зависимость проявлялась в группе ярославской породы между активностью АсАт и удоем и содержанием белка на уровне 0,24 и 0,33 соответственно, активностью АлАт и содержанием белка на уровне 0,38.
Обобщая полученные данные по выявлению связи, как между признаками молочной продуктивности, так и их сопряженности с биохимическими показателями крови, пришли к заключению, что общей закономерностью:
- для ярославской породы явилось высокая положительная связь между жиром и белком молока, активностью ферментов переаминирования (АЛТ и АСТ) и содержанием белка в молоке;
- для улучшенного типа ярославского скота характерна положительная корреляционная связь между активностью ферментов переаминирования и удоем, а также активностью ферментов и содержанием белка в молоке;
- для голштинской породы установлена высокая положительная связь между жиром и белком молока, активностью аспартатаминотрансфераза (АСТ) и содержанием белка в молоке.
Лейкемия считается заболеванием, при возникновении которых чудес не бывает. Самоизлечиться животное не способно, а действенных лекарств еще не разработали.
Ветеринарные службы, Россельхознадзор решают, когда и на какой срок устанавливать карантин при положительных анализах. Как правило, ограничения снимаются лишь спустя год после убоя последней зараженной особи.
Продукция не может реализовываться, из нее нельзя приготовить сыры и кефир. Поэтому созданы специальные пункты убоя крупного рогатого скота, где туши тщательно утилизируются.
В личных целях можно давать пить молоко молодняку после обязательной обработки, потому что вирус гибнет при ста градусах. Также если опухоли успели поразить только лимфоузлы и не развиться по всем органам, можно подвергать здоровые части высоким температурам и употреблять.
Что делать, если анализ на лейкоз положительный? Иногда экономически выгодно ликвидировать все стадо и заменить животных здоровыми. До этого помещения для скота убирают и дезинфицируют трехпроцентным раствором едкого натра. Пока результаты анализов не известны, нельзя ввозить в хозяйство новое поголовье.
После выявления в стаде лейкемии и в профилактических целях животновод организует ежегодное обследование с взятием анализа крови у коров. Для быков сроки составляют раз в полгода.
Лейкоз крупного рогатого скотаЗаголовокЛейкоз крупного рогатого скотаВремя просмотра3:03ЗаголовокО ЛЕЙКОЗЕ коров.Время просмотра21:36ЗаголовокЛейкоз: это важно знатьВремя просмотра17:07
Анализы у коров, быков, молодняка, берут в связи с выявлением определённых заболеваний. В законодательстве закреплен забор крови у КРС 2 раза в год на лейкоз, туберкулёз и бруцеллёз. Исследование крови телят проводят 1 раз в год. Отказ от забора крови приводит к штрафу владельцев животных.
Тест пластины для проведения теста по определению субклинического мастита у коров
Кроме плановых исследований, анализы берут при проведении профилактических мероприятий. Смотрят количество лейкоцитов, скорость оседания эритроцитов, уровень гемоглобина. При подозрении на мастит у коровы исследуют молоко. Во избежание развития остеомаляции, послеродового пореза проводят биохимический анализ мочи.
Перед тем как начать процесс доения, оператор осматривает вымя корове, проверяет молочную железу на наличие мастита. Мастит относится к инфекционным заболеваниям. Возбудителем является стафилококк. В вымя он проникает различными путями:
- через повреждения кожи; при нарушении режима доения, несоблюдении правил ухода за выменем, на коже появляются трещины, через которые проникают болезнетворные бактерии; при укусе насекомого может развиться воспалительный процесс;
- кишечная палочка, грибы и стафилококки попадают в вымя из желудка коровы через мягкие ткани;
- при медикаментозной терапии происходит нарушение микрофлоры в тканях вымени; снижается иммунитет, развивается патологическая микрофлора.
При пальпации молочной железы отмечаются уплотнения. Они возникают в отдельных или во всех долях железы. Вымя становится жёстким, воспалённым, красноватым. Развивается отёчность, железа увеличивается в размерах. Корова испытывает болезненные ощущения при движении и во время процесса доения. Для подтверждения заболевания или опровержения подозрений на мастит, у животного берут на анализ молоко: перед доением сцеживают первые капли.
Исследования на мастит у коров проводят с использованием 5% раствора «Димастина». Берут молочно-контрольную пластику МКП-2. На ней есть 4 углубления для каждой доли вымени, в них сцеживают молоко: по 1 мл в каждую ячейку. В молоко добавляют реактив. Вращают пластинку в горизонтальном положении 15-30 секунд. Анализируют состояние молока:
- мастита нет, если консистенция жидкости не изменилась;
- анализ положительный, если молоко приобрело консистенцию желе; в лунке заметен сгусток;
- если жидкость стала гуще, но желе и сгустка не образовалось, то реакция сомнительная; требуются дополнительные исследования.
При мастите определяется повышенная кислотность. В норме рН 6,5 – жидкость в МКП белое. Если цвет изменился и стал жёлтым, то кислотность выше нормы. Красный цвет указывает на повышенное содержание щёлочи. Молоко приобретает малиновый, пунцовый цвет при ярко выраженной щёлочности.
Вместо «Димастина» могут использовать 10% раствор «Мастидина». Исследования проводят идентичным способом, но цвет жидкости при нарушении рН будет другим:
| № | Полезная информация |
|---|---|
| 1 | светло-сиреневый оттенок – кислотно-щелочной баланс в норме |
| 2 | белый цвет молока – повышенная кислотность |
| 3 | тёмно-сиреневый – повышенная щёлочность |
Если в какой-либо ячейке обнаружился стафилококк, то проводят дополнительные исследования с использованием 2% раствора «Мастидина». Если молоко изменило свою консистенцию и цвет, то применяют методику отстаивания.
У коровы берут последние молоко, по 10 мл из каждой доли железы, которая показала положительную реакцию. Молоко помещают в пробирки, которые ставят в холодильник, чтобы оно не скислось. Анализ проводят на 2 день. Если содержимое пробирок не изменилось, то мастита у животного нет. При наличии следующих признаков отмечается положительная реакция на заболевание:
- появление водянистости;
- выпадение осадка в виде хлопьев;
- тягучесть сливок; они становятся слизистыми;
Корову, у которой определился мастит, отделяют от стада и начинают лечение. Процесс доения проводят 2 раза в день, как животное привыкло. Частый забор молока приведёт к увеличению лактации, что вызовет осложнение заболевания. Молоко использовать для питья или для кормления теленка нельзя. Жидкость уничтожают.
Анализ крови выявляет широкий спектр заболеваний. Забор проводят утром, перед кормлением и доением. Исследуют удельный вес крови, РОЭ, вязкость, свёртывание, химический состав.

Данные показатели позволяют выявить какую-либо патологию, назначить правильную терапию, откорректировать рацион питания.
- Удельный вес крови у КРС в норме – 1,040-1,059 ед. Пониженный показатель определяется у животных, страдающих истощением и анемией. Высокий удельный вес указывает на нефрит, повышенное содержание сахара в крови, лихорадку, развитие воспалительного процесса в организме.
- Вязкость крови у быков и коров в норме – 4,6-5,2 ед. Понижение вязкости происходит при истощении и анемии. Повышенная вязкость отмечается при плеврите, перитоните, воспалении лёгких.
- По замедленной скорости свёртывания крови определяют такие заболевания как нефрит, сибирская язва, гемофилия. У КРС – она в норме 5-6 мин. Повышенный показатель определяется при развитии крупозного воспаления лёгких, при геморрагических анемиях.
- РОЭ по методу Панченкова в норме у взрослых животных 0,5-1,5 мм за 1 ч. У молодняка скорость оседания эритроцитов выше. При анемии, ангине, кровопятнистой болезни наблюдается повышенная РОЭ. Заниженный показатель выявляется при желтухе, гастроэнтерите. У быков невысокая РОЭ может развиваться при миоглобинурии: заболеванием страдают животные с высокой мышечной массой.
- У здоровых животных уровень гемоглобина в крови 9,4-12,5. Снижение гемоглобина вызывает патологические процессы в организме. Коровы страдают анемией. У них появляется желтушность тканей, увеличиваются почки, печень, селезёнка. Кровь приобретает коричневый оттенок, становится водянистой.
Последствия сниженного гемоглобина – дистрофия мышечных тканей, в том числе сердечной мышцы. Дисфункции и дистрофия внутренних органов.
- Определяют количество билирубина в крови. Норма для КРС составляет 0,01-0,30 мг. При повышенном билирубине диагностируется гепатоз: патологические изменения в печени.
- Норма белка в крови у взрослых животных составляет 6,8-9,0 г%. Увеличение или снижения уровня белка приводит к нарушению обмена веществ.
- Корова здоровая, если анализ показал уровень каротина – 0,5-4 мг%. Недостаток витамина «А» приводит к атрофии мышц, воспалению слизистых оболочек, потере зрения. Особенно важно отслеживать уровень каротина у коров в период беременности. Нехватка витамина может вызвать самопроизвольные роды.
- Кровь берут на анализ, чтобы выяснить уровень кальция в крови. У здоровых животных его – 9,5-12,5 мг%. Снижение уровня приводит к развитию остеомаляции, рахиту у молодняка, анемии, лейкемии. Повышенное количество кальция вызывает сердечную недостаточность у коров, деформацию суставов.
- Чтобы предотвратить заболевания опорно-двигательной, сердечнососудистой системы проверяют уровень фосфора в крови. Его норма составляет – 4.5-7,5 мг%.
Общий и биохимический анализ крови позволяет оценить состояние организма. При хорошем уходе за животными, сбалансированном питании, все показатели будут в норме. Отклонения указывают на развития заболеваний внутренних органов животного, нарушение обмена веществ.
Лейкоз относится к хроническим опухолевым заболеваниям. Иногда он не проявляет никаких симптомов, поэтому важно провести у коров забор крови на анализ. В некоторых случаях появляются признаки лейкоцитоза. Разрастаются кроветворные и лимфоидные клетки во внутренних органах. Возбудителем лейкоза является онкорновирус. В организм здорового животного он попадает от больной особи. Лейкоз передаётся через молоко и мясо, поэтому сырьё от лейкозных коров и быков подлежит выбраковке и уничтожению.
%0A
- %0A
- %D0%BF%D1%80%D0%B5%D0%B4%D0%BB%D0%B5%D0%B9%D0%BA%D0%BE%D0%B7%D0%BD%D0%B0%D1%8F%20%D1%81%D1%82%D0%B0%D0%B4%D0%B8%D1%8F%20%E2%80%93%2014%20%D1%82%D1%8B%D1%81./%D0%BC%D0%BA%D0%BB;%20%D0%B2%D0%BD%D0%B5%D1%88%D0%BD%D0%B8%D1%85%20%D1%81%D0%B8%D0%BC%D0%BF%D1%82%D0%BE%D0%BC%D0%BE%D0%B2%20%D0%BD%D0%B5%D1%82; %0A
- %D0%BD%D0%B0%D1%87%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F%20%D1%81%D1%82%D0%B0%D0%B4%D0%B8%D1%8F%20%E2%80%93%20%D0%BE%D1%82%2015%20%D0%B4%D0%BE%2040%20%D1%82%D1%8B%D1%81./%D0%BC%D0%BA%D0%BB;%20%D0%B2%D0%BD%D0%B5%D1%88%D0%BD%D0%B8%D0%B5%20%D0%BF%D1%80%D0%B8%D0%B7%D0%BD%D0%B0%D0%BA%D0%B8%20%D0%B7%D0%B0%D0%B1%D0%BE%D0%BB%D0%B5%D0%B2%D0%B0%D0%BD%D0%B8%D1%8F%20%D0%BD%D0%B5%20%D1%80%D0%B0%D0%B7%D0%B2%D0%B8%D0%B2%D0%B0%D1%8E%D1%82%D1%81%D1%8F; %0A
- %D1%80%D0%B0%D0%B7%D0%B2%D1%91%D1%80%D0%BD%D1%83%D1%82%D0%B0%D1%8F%20%D1%81%D1%82%D0%B0%D0%B4%D0%B8%D1%8F%20%E2%80%93%2040*10%209%20/%D0%BB;%20%D0%BB%D0%B8%D0%BC%D1%84%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5%20%D1%83%D0%B7%D0%BB%D1%8B%20%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D1%8F%D1%82%D1%81%D1%8F%20%D0%B1%D0%BE%D0%BB%D1%8C%D1%88%D0%B5,%20%D1%81%D0%B5%D1%80%D0%B4%D1%86%D0%B5%20%D1%83%D0%B2%D0%B5%D0%BB%D0%B8%D1%87%D0%B8%D0%B2%D0%B0%D0%B5%D1%82%D1%81%D1%8F,%20%D0%BF%D1%83%D0%BB%D1%8C%D1%81%20%D1%81%D0%BB%D0%B0%D0%B1%D0%BE%D0%B3%D0%BE%20%D0%BD%D0%B0%D0%BF%D0%BE%D0%BB%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F;%20%D1%83%20%D0%BA%D0%BE%D1%80%D0%BE%D0%B2%20%D1%80%D0%B0%D0%B7%D0%B2%D0%B8%D0%B2%D0%B0%D1%8E%D1%82%D1%81%D1%8F%20%D0%BE%D1%82%D1%91%D0%BA%D0%B8%20%D0%B2%20%D0%BE%D0%B1%D0%BB%D0%B0%D1%81%D1%82%D0%B8%20%D0%BF%D0%BE%D0%B4%D0%B3%D1%80%D1%83%D0%B4%D0%BA%D0%B0%20%D0%B8%20%D0%BC%D0%B5%D0%B6%D1%87%D0%B5%D0%BB%D1%8E%D1%81%D1%82%D0%BD%D0%BE%D0%B3%D0%BE%20%D0%BF%D1%80%D0%BE%D1%81%D1%82%D1%80%D0%B0%D0%BD%D1%81%D1%82%D0%B2%D0%B0. %0A
%0A
источник